转载自微信公众号:小麦研究联盟
研究背景
小麦族(Triticeae)作物,包括我们熟知的小麦、大麦、黑麦等,是全球最重要的粮食和饲料来源。然而,在这些作物的生长过程中,持续面临着由真菌、病毒等多种病原体引发的病害威胁,每年都造成巨大的产量损失。在众多防治策略中,挖掘并利用植物自身的抗病基因(R基因)被公认为最高效、经济且环境友好的方法。随着基因组学和生物技术的飞速发展,科学家们已经从禾谷族作物及其野生近缘种中克隆了大量R基因。系统地梳理这些基因的类型、作用机制、进化规律及其在育种中的应用,对于指导未来作物抗病改良、保障全球粮食安全具有至关重要的理论和实践意义。
论文概要
以色列海法大学的Tzion Fahima团队与美国加州大学戴维斯分校的Gitta Coaker团队在国际权威综述期刊《Annual Review of Phytopathology》上发表了题为“The Spectrum of Diverse Disease-Resistance Genes Cloned and Characterized in the Triticeae Tribe”的综述论文。该文系统地总结了禾谷族作物中已克隆的超过70个抗病基因座的多样性、进化起源、作用机制及其在抗病育种中的应用。研究指出,这些基因可被划分为四大类型:细胞表面的模式识别受体(PRRs)、胞内的核苷酸结合-富含亮氨酸重复序列(NLR)免疫受体、结构新颖的激酶融合蛋白(KFPs)以及其他非典型抗病基因,共同构成了作物复杂而精密的“免疫系统”。值得注意的是,其中约60%的抗病基因来源于野生近缘种,凸显了野生资源在作物改良中的巨大价值。

主要研究结果介绍
第一道防线:细胞表面模式识别受体(PRRs)
植物免疫的第一道防线由位于细胞表面的模式识别受体(PRRs)构成。它们如同“哨兵”,负责识别病原体相关的分子模式(MAMPs)或植物自身损伤相关的分子模式(DAMPs),从而激活模式触发的免疫(PTI)。在禾谷族作物中,已发现多种PRR参与抗病过程,主要包括以下几类(图1):
壁相关激酶(WAKs):这类受体能与细胞壁的果胶成分结合。例如,小麦的Stb6基因编码一个WAK样蛋白,能够特异性识别小麦壳针孢叶斑病菌(Zymoseptoria tritici)的效应蛋白AvrStb6,从而触发抗病反应。有趣的是,某些WAKs,如小麦的Snn1,在识别病原菌的坏死性效应子SnTox1后,反而会诱导细胞死亡,成为感病基因(S基因),体现了PRR功能的两面性。
富含半胱氨酸的受体样激酶(CRKs):这类蛋白的胞外域具有特征性的DUF26结构域。源自小麦野生近缘种的Stb16q基因就编码一个CRK,能有效抑制小麦壳针孢叶斑病菌在叶片气孔的入侵和早期增殖。
凝集素受体激酶(LecRKs):这类受体通过胞外的凝集素结构域识别糖类分子。小麦的Stb15基因即编码一个G型LecRK,通过识别效应子AvrStb15来介导对小麦壳针孢叶斑病的抗性。
富含亮氨酸重复的受体激酶(LRR-RKs):这是最大的一类PRR。例如,大麦中的Rps8位点通过Pur1(一个LRR-RK)和Exo70FX12(一个外泌体复合体亚基)的协同作用,介导对小麦秆锈菌的非寄主抗性。
LysM受体:这类受体专门识别真菌细胞壁的主要成分——几丁质。研究发现,将二倍体小麦近缘种中的几丁质受体CERK1-V转入普通小麦,可以显著提高其对白粉病、黄锈病和赤霉病的广谱抗性(图1)。
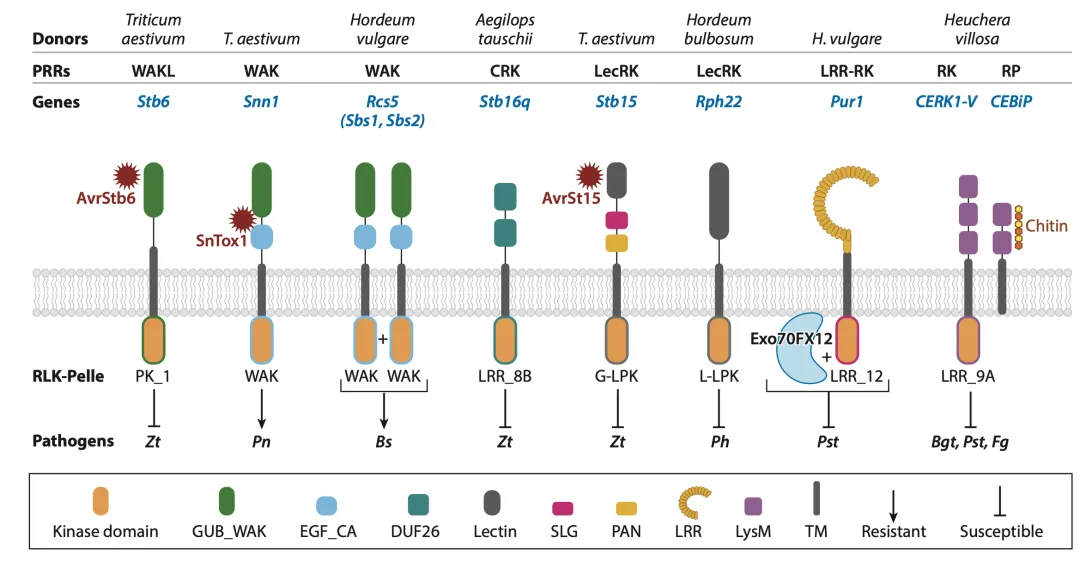 图1
图1
核心力量:胞内NLR免疫受体
NLR受体是植物免疫系统的核心组成部分,构成了第二道防线。它们在细胞内部“巡逻”,直接或间接地识别侵入细胞的病原体效应子,并激活效应子触发的免疫(ETI),这通常伴随着快速的过敏性坏死反应(HR)。在禾谷族已克隆的R基因中,NLRs占比高达55%。
激活机制——抗病小体:研究表明,NLRs在识别效应子后,会发生构象变化,并组装成一个名为“抗病小体”(Resistosome)的多聚体复合物。以小麦抗秆锈基因Sr35为例,当它识别到秆锈菌效应子AvrSr35后,会形成一个五聚体通道蛋白,嵌入细胞膜,引发离子非选择性外流,从而触发免疫反应和细胞死亡(图2a)。
多样的等位基因与进化:多倍化过程为禾谷族作物NLR基因的进化提供了丰富的素材,产生了大量具有新识别特异性的等位基因。例如,小麦的Pm3位点和黑麦的Pm8、Pm17位点是同源基因,但演化出了识别不同白粉菌小种的能力。更有趣的是,单个NLR基因如Yr87/Lr85甚至可以识别两种完全不同的病原菌(分别引起条锈病和叶锈病),这可能源于其识别了一个保守的效应子或效应子靶标(图2b)。
成对的NLRs与整合域(IDs):许多NLRs并非“单兵作战”,而是以“传感器-辅助者”配对的形式工作。例如,小麦的Lr10和RGA2基因对就是一对协同作用的NLR(图2c)。此外,一些NLRs还进化出了特殊的“整合域”(Integrated Domains, IDs),这些结构域模仿病原菌效应子的宿主靶蛋白,充当“诱饵”来捕获效应子。禾谷族作物中发现了带有锌指BED结构域、锚蛋白重复(ANK)结构域和WRKY转录因子结构域等多种ID的NLR。例如,大麦的Rph15和小麦的Yr5/Yr7/YrSP都含有BED结构域;而小麦的YrU1则同时整合了ANK和WRKY结构域(图2d)。
杂种劣势:NLR基因的引入也可能带来负面效应,如杂种劣势。例如,小麦的Lr13基因在提供叶锈病抗性的同时,也是一个杂种致死基因Ne2。
 图2
图2
新兴力量:激酶融合蛋白(KFP)
KFP是一类新发现的非典型R基因,它们的蛋白结构特征是将激酶结构域(KD)与其他功能结构域融合在一起,展现出多样的结构和作用方式。
串联激酶蛋白(TKPs):这类蛋白通常包含两个串联的激酶或假激酶结构域。大麦抗秆锈基因RPG1是第一个被克隆的TKP。在小麦中,也发现了一系列WTK(Wheat Tandem Kinase)基因,如抗白粉病基因Pm24和抗小麦瘟病基因RWT4。研究表明,RWT4可以直接结合并磷酸化小麦瘟病菌的效应子PWT4,从而激活防御反应(图3a)。一些TKP还能与NLRs互作,如Sr62在识别效应子后会招募一个NLR蛋白来激活免疫。
激酶-整合域融合蛋白(KD-IDs):这类蛋白将单个激酶结构域与一个或多个非激酶的整合域融合。例如,小麦抗秆锈基因Sr43将一个激酶域与两个功能未知的DUF结构域融合(图3b);抗白粉病基因Pm4b则将激酶域与多个C2结构域融合,其不同的剪接体在内质网上形成异源复合体发挥功能(图3c);而著名的抗条锈病基因Yr36(也称WKS1)则是一个激酶与一个START脂质结合域的融合蛋白,它在叶绿体中通过磷酸化光合系统蛋白来诱导活性氧(ROS)产生,从而抑制病原菌(图3d)。同样,KFP也可能被病原菌利用,如小麦的Snn3在被效应子SnTox3靶向后会介导感病性。
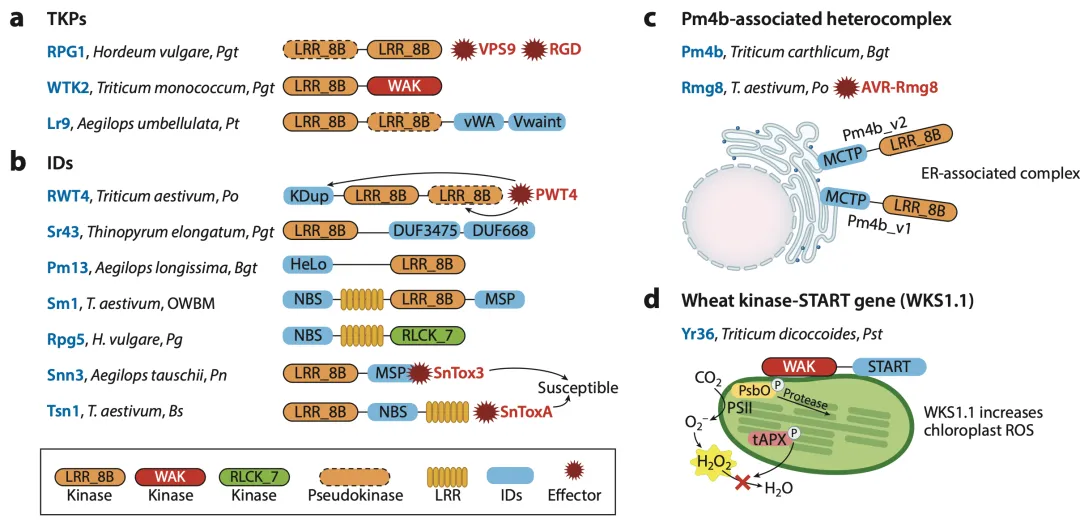 图3
图3
另辟蹊径:其他非典型抗病基因
除了上述三大类基因,禾谷族作物还进化出一些结构和功能独特的非典型R基因。
膜转运介导的抗性:Lr34和Lr67是两个非常著名的广谱、持久抗性基因,它们分别编码一个ABC转运蛋白和一个己糖-质子同转运蛋白。它们并非通过经典的“基因对基因”模式发挥作用,而是通过改变细胞膜的通透性,可能影响了养分或防御信号物质(如脱落酸ABA)的运输,从而营造出不利于病原菌生长的宿主环境,提供了一种慢反应、成株期的抗性(图4a)。
感病基因的负向调控:MLO基因是一个典型的感病基因,其编码的蛋白负向调控植物的防御反应。通过基因编辑或利用自然突变使其功能丧失(mlo),可以获得对白粉病的广谱持久抗性。最新的研究通过精准编辑小麦TaMlo-B1基因,成功获得了高抗白粉病且农艺性状不受影响的优异材料(Tamlo-R32)。
转录因子与免疫调控:一些转录因子也直接参与抗病过程。例如,大麦的Rph7和小麦的YrNAM(即Yr10)都编码含有NAC和BED结构域的转录因子,在病原菌侵染后被诱导表达,调控下游防御基因的表达(图4b)。
毒素中和:病原菌常分泌毒素来致病。小麦的近缘种长穗偃麦草中克隆的Fhb7基因编码一个谷胱甘肽S-转移酶(GST),它能将谷胱甘肽分子共轭到赤霉病菌产生的强毒素——脱氧雪腐镰刀菌烯醇(DON)上,从而使其失活,实现对赤霉病的抗性(图4c)。
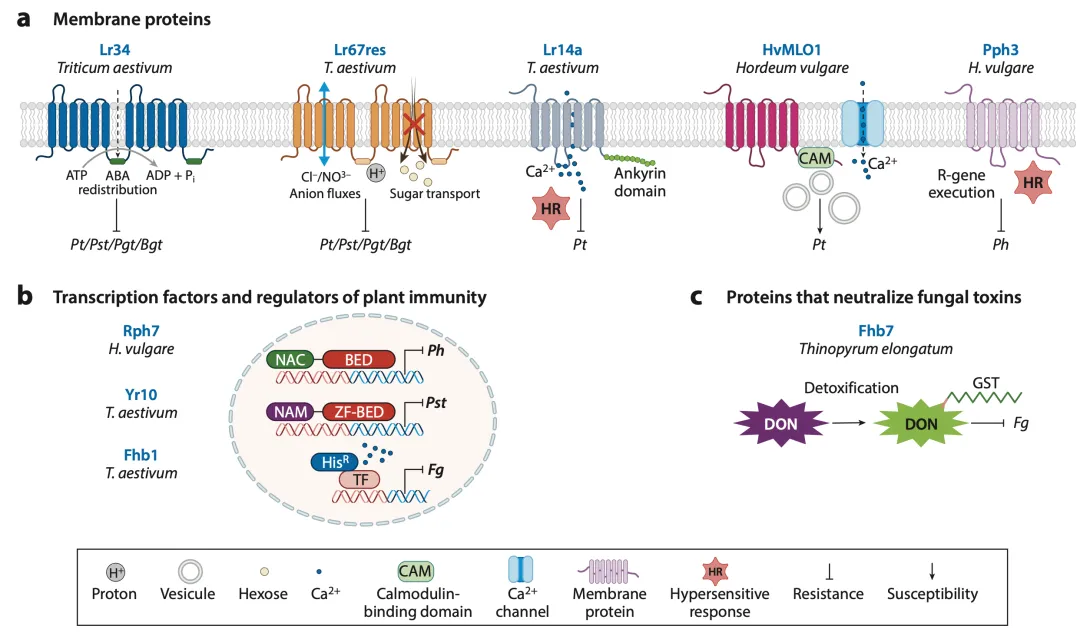 图4
图4
全文总结与展望
本篇综述系统描绘了禾谷族作物抗病基因的宏伟蓝图,揭示了其在结构、功能和进化路径上的高度多样性。从细胞表面的“哨兵”PRRs,到细胞内部的“主力军”NLRs,再到结构新颖的“特种兵”KFPs和其他非典型R基因,它们共同构建了一个多层次、网络化的防御体系。野生近缘种作为抗病基因的宝库,其重要性不言而喻。
展望未来,研究者面临的挑战与机遇并存。首先,利用新一代测序技术,特别是长读长测序,结合高效的基因克隆策略(如TEnSeq),将加速从野生资源中发掘更多新颖的R基因。其次,如何克服将外源基因导入栽培种时面临的连锁累赘问题,是育种应用的关键。再次,通过基因聚合(即将多个R基因堆叠在一起),如已成功构建的包含五个抗秆锈基因的“基因盒”,是实现持久广谱抗性的重要策略。最后,以CRISPR-Cas9为代表的基因编辑技术,为精准改良抗病性提供了前所未有的强大工具,无论是直接引入新基因、修复失效的R基因,还是精准敲除MLO等感病基因,都展现出巨大的应用潜力。深入理解植物与病原菌的互作机制,并结合先进的基因组学和育种技术,将是未来培育高产、优质、持久抗病作物品种,保障全球粮食安全的核心驱动力。
研究团队与资助
本文的第一作者为四川农业大学的李映辉和以色列海法大学的Liubov Govta(共同第一作者)。通讯作者为以色列海法大学的Tzion Fahima和美国加州大学戴维斯分校的Gitta Coaker。该研究工作得到了以色列科学基金会(ISF)、美国-以色列农业研究与发展基金(BARD)、美国国家科学基金会(NSF)、美国农业部(USDA)以及以色列高等教育委员会和中国相关科技部门的博士后奖学金等项目的支持。
DOI: https://doi.org/10.1146/annurev-phyto-121323-031121